Wpis ukazał się 11 kwietnia 2020 roku na nieistniejącej już stronie: naukowa-seksualnosc.pl. Strona zakończyła działalność jesienią 2020 r.
Wprowadzenie
Neuroobrazowanie stanowi (zaraz obok elektroencefalografii) jedną z podstawowych technik badania mózgu. Dzięki niemu możemy zbadać zarówno funkcjonalność, jak i strukturę tego organu. Najpowszechniejszą techniką neuroobrazowania używaną w badaniach naukowych, a także badaniach medycznych jest rezonans magnetyczny (ang. magnetic resonance imaging, MRI), którego celem jest dokładna analiza anatomiczna mózgu. Dzięki technice morfometrii opartej na wokselach (ang. voxel-based morphometry, VBM) oraz obrazowaniu tensora dyfuzji (ang. diffusion tensor imaging, DTI) możemy śledzić także grubość struktur korowych oraz objętość istoty białej, natomiast wiedzę o poszczególnych wzorcach aktywacji mózgowej uzyskujemy dzięki pozytonowej tomografii emisyjnej (ang. positron emission tomography, PET), tomografii emisyjnej pojedynczych fotonów (ang. single-photon emission computed tomography, SPECT) oraz funkcjonalnemu rezonansowi magnetycznemu (ang. functional magnetic resonance imaging, fMRI). Ten ostatni cieszy się największą popularnością w badaniach neuronaukowych na żywym ludzkim mózgu. fMRI oraz metoda traktografii (ang. diffusion tensor tractography) pozwalają ponadto na szczegółową analizę strukturalnych połączeń między obszarami mózgowymi wraz z ich funkcjonalnością1. Techniki te posłużyły badaczom do dokładnego przyjrzenia się zjawisku dysocjacji, o którym traktuje niniejszy post. Szczegółowo o samych tych technikach będziemy również pisać w przyszłości.

Definicja Amerykańskiego Towarzystwa Psychiatrycznego zawarta w klasyfikacji zaburzeń psychicznych DSM-5 określa dysocjację jako: “zakłócenie i/lub brak ciągłości w integracji świadomości, pamięci, tożsamości, emocji, percepcji, reprezentacji ciała, kontroli motorycznej i zachowania” czyli w funkcjach, które standardowo są w człowieku zintegrowane 2, 3. Symptomy świadczące o dysocjacji różnią się w zależności od danego zaburzenia, oscylując od utraty pamięci konkretnych okresów czasowych bądź informacji autobiograficznych, poprzez uczucie odłączenia od siebie i swoich emocji, aż do zaburzonego poczucia odczuwania siebie4. Pośród zaburzeń dysocjacyjnych wróżniamy m.in. amnezję dysocjacyjną, fugę dysocjacyjną, depersonalizację, derealizację, drgawki dysocjacyjne, dysocjacyjne zaburzenia ruchu, dysocjacyjne zaburzenie tożsamości i inne. Zostaną one szczegółowo przybliżone w kolejnych wpisach na stronie.
Wyniki dotychczasowych badań wskazują, iż dysocjacja nie jest tylko i wyłącznie cechą charakterystyczną dla niniejszych zaburzeń. Najczęściej obserwuje się ją w istocie pośród osób cierpiących na zaburzenia dysocjacyjne (w szczególności dysocjacyjne zaburzenie tożsamości, DID), ale również w grupie osób zmagających się z zespołem stresu pourazowego, zaburzeniem osobowości borderline oraz zaburzeniami konwersyjnymi. Jest to ponadto mechanizm spotykany również w wielu innych zaburzeniach psychicznych2 (Obraz 1), przez co wymaga dokładnej staranności w diagnozie pacjenta, a także różnicowania z innymi jednostkami chorobowymi, mogącymi dawać podobne objawy.
Przykładową z nich jest padaczka, cechująca się napadami drgawkowymi spowodowanymi anormalną aktywnością elektryczną mózgu. Osoby doświadczające dysocjacji mogą również doznawać (w odpowiedzi na myśli bądź uczucia związane z obecnymi lub przeszłymi wydarzeniami) podobnego typu sensacji, określanych mianem drgawek dysocjacyjnych, u podłoża których będa leżeć jednakże inne przyczyny, uważane dotychczas za przyczyny wyłącznie psychologiczne (przez wzgląd na brak u tych osób podobnej aktywności mózgowej wykazywanej przy pomocy EEG u pacjentów z epilepsją w trakcie trwania napadu padaczkowego)5, 6. Jak wskazują najnowsze analizy, u podłoża drgawek dysocjacyjnych mogą jednakże leżeć również strukturalne i funkcjonalne anomalie w działalności mózgu7. Zdarza się również (u około 10%-30% pacjentów z drgawkami dysocjacyjnymi), iż epilepsja oraz drgawki dysocjacyjne mogą zostać zdiagnozowane i występować jednocześnie u tej samej osoby, drgawki epileptyczne praktycznie zawsze poprzedzają wówczas moment rozpoczęcia drgawek dysocjacyjnych8, 9. Doświadczenie traumatycznych wydarzeń, takich jak przemoc seksualna jest często odnotowywane w historii pacjentów z psychogenicznymi napadami drgawkowymi10.
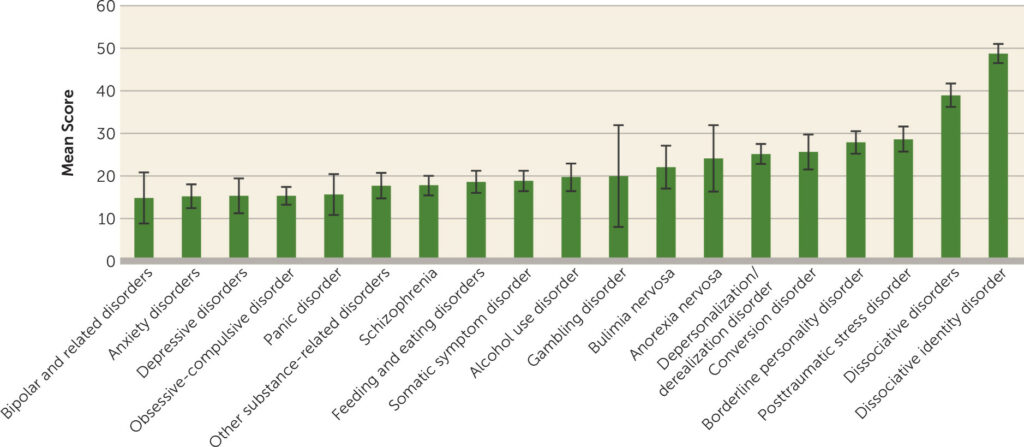
Obraz 1. Średnie wyniki dla doświadczania stanów dysocjacyjnych w przypadku różnych zaburzeń psychicznych, obliczone przy pomocy skali służącej do pomiaru doświadczania dysocjacji (Dissociative Experiences Scale, DES). Słupki błędów wskazują na 95% przedział ufności. Metaanaliza przeprowadzona przez Lyssenko i in. (2018) na podstawie 216 badań (n=15,219).
Dysocjacja spotykana jest także niekiedy wśród innych pacjentów neurologicznych i uważana jest za powszechny mechanizm zaangażowany w powstawanie wielu symptomów funkcjonalnych (psychogennych) zaburzeń neurologicznych1, określanych powszechnie mianem zaburzeń konwersyjnych. Grupa tych pacjentów cechuje się wyższym poziomem podatności na hipnozę oraz wysoką częstotliwością wystepowania symptomów i zaburzeń dysocjacyjnych11.
Uwzględniając historie osób opisujących swoje wyzwania związane z dysocjacją, interesującym wydaje się być zbadanie występowania zaburzeń dysocjacyjnych oraz epizodów dysocjacji w grupie osób ze spektrum autyzmu oraz porównanie doświadczanych przez nich meltdown’ów (tj. przejawiania ekstremalnych zachowań wskutek nadmiernego napięcia emocjonalnego12) i shutdown’ów (tj. odcięć od świata zewnętrznego wskutek nadmiernego napięcia emocjonalnego12) z mechanizmem dysocjacji, jak i też dokonania różnicowania zaburzeń dysocjacyjnych i zaburzeń ze spektrum autyzmu, pamiętając, iż grupa osób z autyzmem jest jedną ze szczególnie narażonych na negatywne doświadczenia w okresie dzieciństwa oraz przeżywanie wskutek nich traumy13, co stanowi zwiększone ryzyko dla rozwoju zaburzeń dysocjacyjnych. Temat ten pozostaje wciąż niezbadany na naukowym polu14, 15.
Zaburzenia dysocjacyjne a trauma
Zaburzenia dysocjacyjne rozwijają się zazwyczaj wskutek doświadczania traumatycznych przeżyć i stanowią pewną formę mimowolnej ucieczki od rzeczywistości, co może przyczyniać się do problemów w codziennym funkcjonowaniu. W czasie wydarzeń stresowych, symptomy dysocjacyjne mogą ulec nasileniu, znacznie uwidaczniając zaburzenie otoczeniu zewnętrznemu4. Do grupy pacjentów o zwiększonym ryzyku rozwoju zaburzeń dysocjacyjnych należą osoby, które doświadczyły przemocy fizycznej, seksualnej oraz emocjonalnej, a przede wszystkim dzieci4, dla których dysocjacja jest jedną z naturalnych form radzenia sobie z trudnymi zdarzeniami16.
Zarówno dysocjacja psychoformiczna (procesy psychiczne dotyczące myśli lub pamięci), jak i somatoformiczna (związana z sensomotorycznymi aspektami doświadczeń urazowych) może przejawiać się w postaci objawów negatywnych (utrata percepcji lub kontroli) bądź/oraz pozytywnych (intruzje). Objawy somatoformiczne obejmują także zjawiska określane jako konwersyjne i niektóre somatyzacyjne17.
Pacjenci z dysocjacyjnym zaburzeniem tożsamości (DID) oraz DDNOS (DSM-IV: dissociative disorder not otherwise specified, w DSM-V zmienione na: other specified dissociative disorder, OSDD ) prezentują najwyższe nasilenie symptomów dysocjacji somatoformicznej. Na symptomy dysocjacji psychoformicznej i somatoformicznej składają się m.in.17, 18.
Objawy pozytywne (intruzje):
– psychoformiczne: takie jak flashbacki, słyszenie głosów;
– somatoformiczne: takie jak występowanie wrażeń zmysłowych związanych z traumatycznym wspomnieniem (bólu, smaku, zapachu), też występowanie ruchów mimowolnych, drgawek, itp.
Objawy negatywne:
– psychoformiczne: takie jak utrata pamięci (amnezja)
– somatoformiczne: takie jak całkowita lub częściowa utrata: wzroku, słuchu, zapachu, smaku lub wrażeń kinestetycznych, też utrata kontroli nad ruchami dowolnymi ciała.
Badania neuronaukowe z wykorzystaniem metod neuroobrazowania
Zarówno przy pomoc metod neuroobrazowania, jak i EEG, badamy pacjenta w czasie rzeczywistym wykonywania procedury, stąd badanie dysocjacji jest zadaniem nie lada trudnym. Uzyskiwane wyniki nie zawsze są z sobą spójne, dlatego zagadnienie to wymaga wciąż intensywnych analiz w celu ustalenia poszczególnych neurobiologicznych korelatów stanów dysocjacyjnych. Tendencja do dysocjacji uznawana jest za cechę wrodzoną19, nie jest wciąż jednak sprecyzowanym czy u podłoża tego zjawiska leży struktura mózgu, poszczególna aktywność mózgu czy też funkcjonowanie poszczególnych sieci neuronalnych1.
Przy pomocy metody DTI wykazano choćby, iż tendencja do wchodzenia w stan dysocjacji u kobiet z zaburzeniem osobowości borderline koreluje negatywnie z integralnością istoty białej w obszarach czołowych20. Wśród osób z borderline odnotowano także, iż ostre stany dysocjacji związane są ze zwiększoną funkcjonalną łacznością w wyspie i obniżoną łącznością w klinie (obszar płata potylicznego)21.
Zaburzenia dysocjacyjne wiążą się niekiedy z doświadczaniem stanów hipnotycznych. Dysocjacja pojawiająca się w hipnozie uważana jest jednakże za średnią w swojej intensywności w porównaniu do tej pojawiającej się spontanicznie i w sposób niekontrolowany, która przybiera ciężką formę dysocjacji i wiąże się z emocjonalnym stresem i traumatycznymi doświadczeniami1.
Hipnoza postrzegana jest jednakże przez niektórych badaczy jako potencjalny model dla badań zaburzeń konwersyjnych22, 23, stąd jej podłoże neurobiologiczne zostanie omówione pokrótce na końcu tego wpisu.
Dysocjacja a psychogenne zaburzenia neurologiczne
Psychogenne zaburzenia neurologiczne (ang. functional neurological disorders, FND), określane częściej w języku polskim mianem zaburzeń konwersyjnych (ang. conversion disorder), są grupą zaburzeń neuropsychiatrycznych objawiających się obecnością symptomów neurologicznych pod nieobecność medycznej przyczyny. U pacjentów tych nie wykazuje się obecności żadnych nieprawidłowości neurologicznych, które mogłyby być powiązane z zaistniałymi objawami. Diagnoza tych osób zazwyczaj polega na wykluczeniu mogących dawać poszczególne objawy schorzeń i trwa często bardzo długi okres czasu24.
Symptomami, na które może cierpieć osoba z FND są m.in.: słabość lub paraliż, drżenia i inne niestandardowe ruchy ciała takie jak mioklionie (gwałtowne skurcze mięśni), zaburzenia równowagi, zaburzenia mowy, utrata czucia bądź też anomalie słuchowe, wizualne czy też węchowe24. Tego typu objawy somatoformiczne zostały przedstawione już we wcześniejszej części wpisu. Do symptomów tych zalicza się również drgawki dysocjacyjne25. Szacuje się, iż około 20-25% pacjentów neurologicznych może przejawiać symptomy FND25.
Czynnikami predysponującymi do rozwoju zaburzeń konwersyjnych są m.in.: historia wykorzystywania seksualnego badź też doświadczenie innych traumatycznych wydarzeń; zwiększony stres, lęk oraz symptomy paniki; zwiększona aleksytymia (niezdolność do rozumienia lub identyfikowania emocji oraz ich nazywania i wyrażania); współwystępujące zaburzenia dysocjacyjne, doświadczanie bólu chronicznego oraz funkcjonalne i strukturalne anomalie mózgowe26.
Wielu pacjentów z FND spełnia kryteria diagnostyczne dla innych zaburzeń cechujących się dysocjacją22 w tym PTSD27 oraz zaburzeń osobowości borderline28 i na odwrót, cielesne symptomy somatyczne (nia mające podłoża medycznego) odnotowywane są często u osób z diagnozą zaburzeń dysocjacyjnych29 oraz PTSD30. Sylvie van der Kruijs wraz ze współpracownikami1, powołując się na próby zredefiniowania zaburzeń dysocjacyjnych przez Ellert R. S. Nijenhuis i Onno van der Hart18, proponują nawet określanie symptomów psychogennych zaburzeń neurologicznych jako epizodów dysocjacji o manifestacji somatoformicznej.
U pacjentów z funkcjonalnymi symptomami neurologicznymi (a dokladniej motorycznymi), badania z wykorzystaniem metod neuroobrazowania wykazały obniżoną aktywność w skryżowaniu skroniowo-ciemieniowym (ang. temporo-parietal junction, TPJ)31, dodatkowej korze ruchowej (ang. supplementary motor area, SMA)32 i zakręcie nadbrzeżnym (ang. supramarginal gyrus)33. Wykazano ponadto zwiększoną aktywność w obszarach limbicznych oraz w obszarze zakrętu obręczy32.
Jak wskazują badania, symptomy neurologiczne i dysocjacja odnotowywane są częściej wśród osób z wysoką podatnością na hipnozę34. Z podatnością na hipnozę i doświadczanie dysocjacji związane są natomiast anatomiczne anomalie mózgowe oraz grubość kory mózgowej1.
W badaniu przeprowadzonym przez Perez i in. (2017), wśród grupy osób cierpiących na psychogenne zaburzenia neurologiczne, u jednostek cechujących się wysokimi wskaźnikami dysocjacji pod postacią somatyczną wykazano zmniejszoną grubość przedniej części kory lewego zakrętu obręczy (ang. anterior cingulate cortex, ACC) w obszarze ogonowym w porównaniu do zdrowej grupy osób22 (Obraz 2). Obszar ten zaangażowany jest w dokonywanie oceny i behawioralną ekspresję stanów afektywnych.
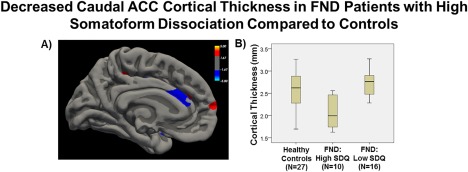
Obraz 2. Po lewej: Zmniejszona grubość przedniej części kory lewego zakrętu obręczy w obszarze ogonowym u osób cierpiących na psychogenne zaburzenia neurologiczne. Po prawej: Porównanie grubości kory niniejszego obszaru pomiędzy osobami zdrowymi (healthy controls), osobami z FND o wysokim wskaźniku somatoformicznej dysocjacji (FND: High SDQ) oraz osobami z FND o niskim wskaźniku somatoformicznej dysocjacji (FND: Low SDQ), p < 0.01 (Perez i in. 2017).
Porównania wewnątrzgrupowe wykazały ponadto, iż częstotliwość doświadczania dysocjacji koreluje ujemnie z grubością przedniej części kory lewego zakrętu obręczy (ACC) w obszarze ogonowym u tych pacjentów (Obraz 3), co oznacza, że im intensywniej pacjenci ci doznają dysocjacji, tym mniejszą grubością tego obszaru się cechują.
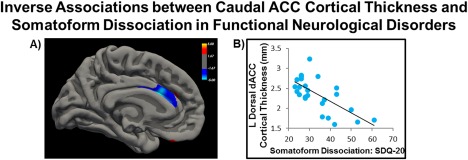
Obraz 3. Ciężkość doświadczanej somatoformicznej dysocjacji koreluje ujemnie z grubością przedniej części kory lewego zakrętu obręczy (ACC) w obszarze ogonowym u pacjentów z FND, p < 0.01 (Perez i in. 2017).
Wykazano ponadto, iż wyniki uzyskiwane w kwestionariuszu mierzącym stopień depersonalizacji/derealizacji korelują pozytywnie z grubością prawej potylicznej kory mózgowej (obszaru związanego z przetwarzaniem bodźców wzrokowych) po bocznej stronie w tej grupie osób (Obraz 4). Wskazuje to, iż zaburzona percepcja siebie i/lub otoczenia może mieć związek z zaburzeniami w obszarach korowych związanych z przetwarzaniem wzrokowym.
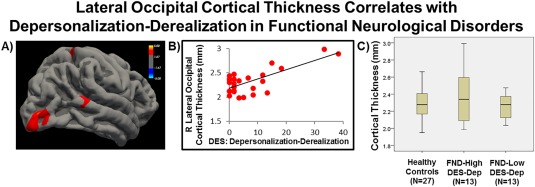
Obraz 4. A, B: Stopień depersonalizacji/derealizacji koreluje pozytywnie z grubością prawej potylicznej kory mózgowej po bocznej stronie u osób z FND. C: Wykresy pudełkowe ukazujące medianę, kwartyle i zakres grubości niniejszego obszaru odnotowany u zdrowych osób, 13 pacjentów z FND z najwyższym wynikiem na skali depersonalizacji/derealizacji oraz 13 pacjentów z FND z najniższym wynikiem na skali depersonalizacji/derealizacji, p < 0.01 (Perez i in. 2017).
Wyniki niniejszego badania wspierją hipotezę przemawiającą za potencjalną rolą przedniego zakrętu obręczy w neuropatologii somatoformicznej dysocjacji. Wniosek ten zgodny jest z dotychczasową literaturą na ten temat35, 36, 37, wymagane są jednak dalsze badania w celu ustalenia, czy w neurobiologii powstawania tego zaburzenia główną rolę odgrywa ogonowy obszar przedniego zakrętu obręczy (caudal ACC), czy może szerzej zaburzony profil funkcjonowania neuronalnej sieci określanej mianem sieci istotności (salience network, SN)22, obejmującej obszary przedniej części wyspy (anterior insula, AI) oraz grzbietowej przedniej kory obręczy (dorsal anterior cingulate cortex, dACC)38. Sieć ta “pełni funkcję dynamicznego przełącznika między koncentracją na sobie i własnym świecie wewnętrznym”, odpowiadając za adekwatność zachowania jednostki względem sytuacji39.
Z kolei w innym badaniu przeprowadzonym przez Perez i in. (2017), wśród osób płci żeńskiej cierpiących na zaburzenia konwersyjne odnotowano zmniejszenie objętości istoty szarej w lewej przedniej wyspie, co było związane z ciężkością zgłaszanych funkcjonalnych symptomów sensorycznych, jak i ciężkością przemocy doświadczanej w dzieciństwie (Obraz 5)22, 40.
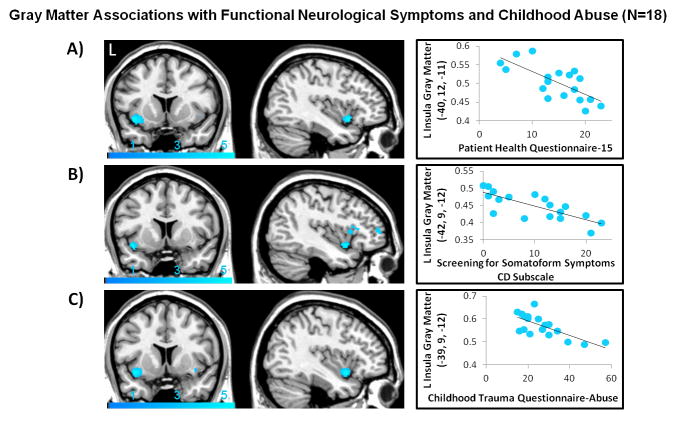
Obraz 5. Objętość istoty szarej w lewej przedniej wyspie koreluje negatywnie z symptomami zaburzeń konwersyjnych i ciężkością przemocy doświadczanej w dzieciństwie u osób płci żeńskiej z FND (Perez i in. 2017).
Wyniki niniejszego badania pokazały także, iż ciężkość doświadczanych symptomów PTSD (nadpobudliwości i unikania) była związana z mniejszą objętością grzbietowego obszaru przedniej części kory zakrętu obręczy w grupie osób cierpiącej na FND, natomiast ciężkość negatywnych wydarzeń doświadczanych w przeciągu całego życia związana była ze zmniejszeniem się objętości hipokampa w tej grupie osób (Obraz 6)22, 40.
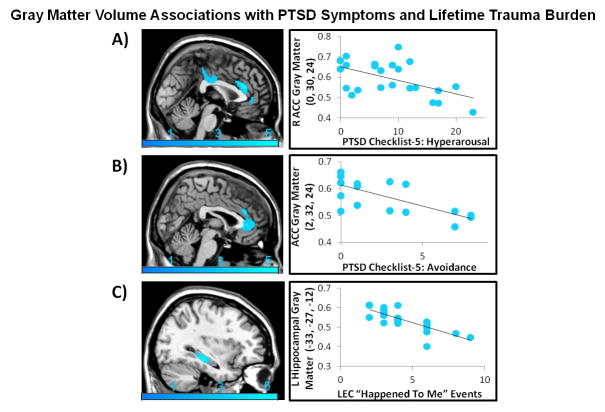
Obraz 6. W grupie osób cierpiących na FND, ciężkość doświadczanych symptomów PTSD (A: nadpobudliwości u wszystkich badanych, B: unikania w grupie kobiet) związana jest z mniejszą objętością istoty szarej w A: grzbietowym obszarze przedniej części kory zakrętu obręczy, B: grzbietowym obszarze przedniej części kory zakrętu obręczy oraz przykolankowej przedniej części zakrętu obręczy, natomiast C: ciężkość negatywnych wydarzeń doświadczanych w przeciągu całego życia związana jest z mniejszą objętością lewego hipokampa w porównaniu do osób zdrowych22, 40 (Perez i in. 2017).
Warto nadmienić, iż analiza funkcjonalnej łączności wykazała również zmiany w funkcjonowaniu sieci mózgowych u pacjentów z objawami psychogennych zaburzeń neurologicznych1, potrzeba jednakże wciąż kolejnych badań na ten temat, a wszelkie interpretacje następnych wyników należałoby interpretować z uwzględnieniem tych danych.
Dysocjacja a hipnoza
Hipnoza postrzegana jest przez niektórych badaczy jako potencjalny model dla badań zaburzeń z zakresu FND22, 23. Badania i analizy wykonywane przy pomocy fMRI i PET wykazały, iż najbardziej aktywnymi obszarami mózgu podczas hipnozy są przednia część kory zakrętu obręczy i wzgórze1, 41. Wykazano ponadto obniżoną aktywność w pierwszorzędowej korze sensorycznej, środkowej części zakrętu obręczy, przedklinku i korze wzrokowej42. W niektórych badaniach jednakże, odnotowywano również obniżenie aktywności w obszarze przedniej części kory zakrętu obręczy1, 43. Podczas hipnozy odnotowano także zwiększoną funkcjonalną łączność pomiędzy korą przedczołową i przedklinkiem z obszarami motorycznymi i somatosensorycznymi1, 44, 45, 46. Wykazano dodatkowo obniżenie funkcjonalnej łączności w bocznej części kory czołowo-ciemieniowej oraz obszarze przyhipokampowym47.
Badania wskazują na pozytywny związek między podatnością na hipnozę a wielkością ciała modzelowatego, a dokładniej jego części określanej mianem dzioba. Obszar ten zaangażowany jest w zmianę uwagową i transfer informacji pomiędzy obszarami kory przedczołowej, co sugeruje, iż osoby z tej grupy mają bardziej “efektywny” czołowy system uwagowy obejmujący takie funkcje jak kontrolę, monitorowanie wykonania i hamowanie niechcianych bodźców przed docieraniem ich do świadomości48.
Bibliografia
Literatura (chronologicznie):
1. Van der Kruijs, S. J. M., Bodde, N. M. G., Carrette, E., Lazeron, R. H. C., Vonck, K. E. J., Boon, P. A. J. M., … Aldenkamp, A. P. (2012). Neurophysiological correlates of dissociative symptoms. Journal of Neurology, Neurosurgery & Psychiatry, 85(2), 174–179.
2. Lyssenko, L., Schmahl, C., Bockhacker, L., Vonderlin, R., Bohus, M., & Kleindienst, N. (2018). Dissociation in Psychiatric Disorders: A Meta-Analysis of Studies Using the Dissociative Experiences Scale. American Journal of Psychiatry, 175(1), 37–46.
3. American Psychiatric Association, What Are Dissociative Disorders? (dostęp: 31.03.2020)
4. Mayo Foundation for Medical Education and Research (2017), Dissociative disorders (dostęp: 31.03.2020)
5. British Epilepsy Association (2018), What makes dissociative seizures happen? (dostęp: 01.04.2020)
6. Perez, D. L., & LaFrance, W. C. (2016). Nonepileptic seizures: an updated review. CNS Spectrums, 21(03), 239–246.
7. Mcsweeney, M., Reuber, M., & Levita, L. (2017). Neuroimaging studies in patients with psychogenic non-epileptic seizures: A systematic meta-review. NeuroImage: Clinical, 16, 210–221.
8. Mellers, J. D. C. (2005). The approach to patients with “non-epileptic seizures.” Postgraduate Medical Journal, 81(958), 498–504.
9. Fritzsche, K., Baumann, K., Götz-Trabert, K., & Schulze-Bonhage, A. (2013). Dissociative Seizures. Deutsches Aerzteblatt International, 110(15), 263–268.
10. Harden, C. L. (1997). Pseudoseizures and dissociative disorders: a common mechanism involving traumatic experiences. Seizure, 6(2), 151–155.
11. Bell, V., Oakley, D. A., Halligan, P. W., & Deeley, Q. (2010). Dissociation in hysteria and hypnosis: evidence from cognitive neuroscience. Journal of Neurology, Neurosurgery & Psychiatry, 82(3), 332–339.
12. Autism West Midlands (2016). Meltdown and shutdown in people with autism (dostęp: 01.04.2020)
13. Fuld, S. (2018). Autism Spectrum Disorder: The Impact of Stressful and Traumatic Life Events and Implications for Clinical Practice. Clinical Social Work Journal, 46(3), 210–219.
14. Quora (2018), Are people with ASD more prone to dissociation/dissociative episodes? (dostęp: 01.04.2020)
15. Quora (2020), Can dissociative disorders be misdiagnosed as autism? (dostęp: 01.04.2020)
16. Helios J., Jedlecka W. Dysocjacja jako “hard case” w systemie prawa. E-Wydawnictwo. Prawnicza i Ekonomiczna Biblioteka Cyfrowa, Wydział Prawa, Administracji i Ekonomii Uniwersytetu Wrocławskiego, Wrocław 2015
17. Pietkiewicz I. (2018), Dysocjacja somatoformiczna – walidacja narzędzia SDQ-20 (dostęp: 07.04.2020)
18. Nijenhuis, E. R. S., & van der Hart, O. (2011). Dissociation in Trauma: A New Definition and Comparison with Previous Formulations. Journal of Trauma & Dissociation, 12(4), 416–445.
19. Butler L. D., Duran R. E., Jasiukaitis P., Koopman C., Spiegel D. (1996). Hypnotizability and traumatic experience: a diathesis-stress model of dissociative symptomatology. American Journal of Psychiatry, 153, 42–63.
20. Rüsch, N., Weber, M., Il’yasov, K. A., Lieb, K., Ebert, D., Hennig, J., & van Elst, L. T. (2007). Inferior frontal white matter microstructure and patterns of psychopathology in women with borderline personality disorder and comorbid attention-deficit hyperactivity disorder. NeuroImage, 35(2), 738–747.
21. Wolf, R. C., Sambataro, F., Vasic, N., Schmid, M., Thomann, P. A., Bienentreu, S. D., & Wolf, N. D. (2011). Aberrant connectivity of resting-state networks in borderline personality disorder. Journal of psychiatry & neuroscience : JPN, 36(6), 402–411.
22. Perez, D. L., Matin, N., Williams, B., Tanev, K., Makris, N., LaFrance, W. C., & Dickerson, B. C. (2017). Cortical thickness alterations linked to somatoform and psychological dissociation in functional neurological disorders. Human Brain Mapping, 39(1), 428–439.
23. Deeley, Q. (2016). Hypnosis as a model of functional neurologic disorders. Functional Neurologic Disorders, Handbook of Clinical Neurology, 139, 95–103.
24. Girouard E., Savoie I., Witkowski L. C. (2019). Functional Neurological Symptom Disorder: A Diagnostic Algorithm, Behavioural Neurology, 3154849
25. Black D. W., Andreasen N. C., Introductory Textbook of Psychiatry in The American Psychiatric Publishing textbook of psychiatry, American Psychiatric Publishing, a Division of American Psychiatric Association. Washington, DC, USA, 2014, 271–275.
26. Fobian, A. D., & Elliott, L. (2019). A review of functional neurological symptom disorder etiology and the integrated etiological summary model. Journal of psychiatry & neuroscience : JPN, 44(1), 8–18.
27. Myers, L., Perrine, K., Lancman, M., Fleming, M., & Lancman, M. (2013). Psychological trauma in patients with psychogenic nonepileptic seizures: Trauma characteristics and those who develop PTSD. Epilepsy & Behavior, 28(1), 121–126.
28. Stone, J., Sharpe, M., & Binzer, M. (2004). Motor Conversion Symptoms and Pseudoseizures: A Comparison of Clinical Characteristics. Psychosomatics, 45(6), 492–499.
29. Saxe G. N., Chinman G., Berkowitz R., Hall K., Lieberg G., Schwartz J., van der Kolk B. A. (1994). Somatization in patients with dissociative disorders. American Journal of Psychiatry, 151(9), 1329–1334.
30. van der Kolk B. A., Pelcovitz D., Roth S., Mandel F. S., McFarlane A., Herman J. L. (1996). Dissociation, somatization, and affect dysregulation: The complexity of adaptation of trauma. American Journal of Psychiatry, 153(7 Suppl), 83–93.
31. Voon, V., Gallea, C., Hattori, N., Bruno, M., Ekanayake, V., & Hallett, M. (2010). The involuntary nature of conversion disorder. Neurology, 74(3), 223–228.
32. Voon, V., Brezing, C., Gallea, C., & Hallett, M. (2011). Aberrant supplementary motor complex and limbic activity during motor preparation in motor conversion disorder. Movement Disorders, 26(13), 2396–2403.
33. Van Beilen, M., de Jong, B. M., Gieteling, E. W., Renken, R., & Leenders, K. L. (2011). Abnormal Parietal Function in Conversion Paresis. PLoS ONE, 6(10), e25918.
34. Roelofs, K., Hoogduin, K. A. L., Keijsers, G. P. J., Näring, G. W. B., Moene, F. C., & Sandijck, P. (2002). Hypnotic susceptibility in patients with conversion disorder. Journal of Abnormal Psychology, 111(2), 390–395.
35. Perez, D. L., Dworetzky, B. A., Dickerson, B. C., Leung, L., Cohn, R., Baslet, G., & Silbersweig, D. A. (2014). An Integrative Neurocircuit Perspective on Psychogenic Nonepileptic Seizures and Functional Movement Disorders. Clinical EEG and Neuroscience, 46(1), 4–15.
36. Voon, V., Cavanna, A. E., Coburn, K., Sampson, S., Reeve, A., & LaFrance, W. C. (2016). Functional Neuroanatomy and Neurophysiology of Functional Neurological Disorders (Conversion Disorder). The Journal of Neuropsychiatry and Clinical Neurosciences, 28(3), 168–190.
37. Van der Kruijs, S. J. M., Bodde, N. M. G., Vaessen, M. J., Lazeron, R. H. C., Vonck, K., Boon, P., Hofman P. A. M., Backes W. H., Aldenkamp A. P., Jansen, J. F. A. (2011). Functional connectivity of dissociation in patients with psychogenic non-epileptic seizures. Journal of Neurology, Neurosurgery & Psychiatry, 83(3), 239–247.
38. Sridharan, D., Levitin, D. J., & Menon, V. (2008). A critical role for the right fronto-insular cortex in switching between central-executive and default-mode networks. Proceedings of the National Academy of Sciences, 105(34), 12569–12574.
39. Zajkowski, W., & Jankowiak-Siuda, K. (2014). Review article. Role of the salience network in cognitive and affective impairments. Neuropsychiatria i Neuropsychologia/Neuropsychiatry and Neuropsychology, 9(3), 112-119.
40. Perez, D. L., Matin, N., Barsky, A., Costumero-Ramos, V., Makaretz, S. J., Young, S. S., … Dickerson, B. C. (2017). Cingulo-insular structural alterations associated with psychogenic symptoms, childhood abuse and PTSD in functional neurological disorders. Journal of Neurology, Neurosurgery & Psychiatry, 88(6), 491–497.
41. Rainville, P., Hofbauer, R. K., Bushnell, M. C., Duncan, G. H., & Price, D. D. (2002). Hypnosis Modulates Activity in Brain Structures Involved in the Regulation of Consciousness. Journal of Cognitive Neuroscience, 14(6), 887–901.
42. Schulz-Stübner, S., Krings, T., Meister, I. G., Rex, S., Thron, A., & Rossaint, R. (2004). Clinical hypnosis modulates functional magnetic resonance imaging signal intensities and pain perception in a thermal stimulation paradigm. Regional anesthesia and pain medicine, 29(6), 549–556.
43. McGeown, W. J., Mazzoni, G., Venneri, A., & Kirsch, I. (2009). Hypnotic induction decreases anterior default mode activity. Consciousness and Cognition, 18(4), 848–855.
44. Cojan, Y., Waber, L., Schwartz, S., Rossier, L., Forster, A., & Vuilleumier, P. (2009). The Brain under Self-Control: Modulation of Inhibitory and Monitoring Cortical Networks during Hypnotic Paralysis. Neuron, 62(6), 862–875.
45. Pyka, M., Burgmer, M., Lenzen, T., Pioch, R., Dannlowski, U., Pfleiderer, B., Ewert, A. W., Heuft, G., Arolt, V., & Konrad, C. (2011). Brain correlates of hypnotic paralysis-a resting-state fMRI study. NeuroImage, 56(4), 2173–2182.
46. Vanhaudenhuyse, A., Boly, M., Balteau, E., Schnakers, C., Moonen, G., Luxen, A., Lamy, M., Degueldre, C., Brichant, J. F., Maquet, P., Laureys, S., & Faymonville, M. E. (2009). Pain and non-pain processing during hypnosis: a thulium-YAG event-related fMRI study. NeuroImage, 47(3), 1047–1054.
47. Demertzi, A., Soddu, A., Faymonville, M. E., Bahri, M. A., Gosseries, O., Vanhaudenhuyse, A., Phillips, C., Maquet, P., Noirhomme, Q., Luxen, A., & Laureys, S. (2011). Hypnotic modulation of resting state fMRI default mode and extrinsic network connectivity. Progress in brain research, 193, 309–322.
48. Horton, J. E., Crawford, H. J., Harrington, G., Hunter Downs III, J. (2004). Increased anterior corpus callosum size associated positively with hypnotizability and the ability to control pain. Brain, 127(8), 1741–1747.

